Mécanismes adsorption et absorption
- Définitions simples
- Les différences essentielles
- Mécanismes : surface, pores, affinité
- Exemples du quotidien
- Application en filtration de l’eau
- Limites, idées reçues et points de vigilance
- FAQ
On me pose régulièrement la question : comment le filtre Amilo peut-il retenir les molécules de pesticides ou de médicaments et pas celles des minéraux essentiels à la santé ? Comment ce tri des “bonnes” et “mauvaises” molécules est-il possible ?
Grâce à l’adsorption et l’absorption !
Absorption : grâce à des milliers de « tubes piégeurs », la cartouche retient les particules les plus grosses par un mode de rétention. Il s’agit d’un mode « mécanique ».
Adsorption : La cartouche agit comme un électroaimant qui « colle » les molécules indésirables par polarité. C’est pour cela que les molécules organiques (minéraux…) sont laissées libres alors que les molécules de synthèse (pesticides, métaux lourds) sont attrapées car elles sont d’une charge opposée à celle du charbon. C’est la raison pour laquelle le filtre Amilo retient peu les nitrates, qui sont des molécules organiques. Ceci dit, la question des nitrates divise la communauté scientifique et je vous invite à lire les documents PDF que vous trouverez ici. On parle ici de micro-filtration et le chiffre de 0,5 µ donné par Amilo est relatif, car par le phénomène d’adsorption décrit plus haut, des particules encore plus petites peuvent être « aimantées ».
Pour les férus de chimie, voici l’article de Wiki: https://fr.wikipedia.org/wiki/Adsorption
Note importante : dans ce qui suit, les explications sont volontairement pédagogiques. En pratique, la rétention d’un polluant dépend souvent de plusieurs phénomènes combinés (taille, forme, solubilité, interactions chimiques, vitesse d’écoulement, etc.).
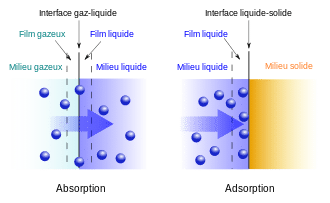
Définitions simples : adsorption et absorption
Qu’est-ce que l’absorption ?
L’absorption correspond à la pénétration d’une substance dans le volume d’un matériau (ou d’un liquide). Autrement dit, la substance ne reste pas seulement à la surface : elle “entre” et se répartit à l’intérieur.
- Exemple : une éponge qui “boit” de l’eau (l’eau se retrouve dans l’épaisseur de l’éponge).
- Exemple : du dioxyde de carbone qui se dissout dans l’eau (absorption/dissolution dans le liquide).
Qu’est-ce que l’adsorption ?
L’adsorption correspond à la fixation d’une substance à la surface d’un matériau. La substance s’accroche sur les parois externes ou internes (dans les pores), sans forcément “entrer” dans le matériau au sens volumique.
- Exemple : des molécules qui se fixent sur du charbon actif.
- Exemple : des odeurs captées par certains matériaux poreux.
À retenir : absorption = “dans la masse”, adsorption = “sur la surface”.
Les différences essentielles (en une minute)
- Lieu du phénomène : adsorption sur une surface ; absorption dans un volume.
- Matériaux typiques : adsorption avec surfaces très développées (charbon actif, zéolithes, résines) ; absorption avec matériaux capables d’“ingérer” (éponges, solvants, polymères, certains gels).
- Vitesse : l’adsorption peut être très rapide au début (surface disponible), puis ralentir ; l’absorption dépend souvent de la diffusion interne.
- Réversibilité : les deux peuvent être réversibles, mais cela dépend des interactions et des conditions (température, concentration, pH, etc.).
- Ce que l’on mesure : adsorption = quantité fixée par unité de surface / masse ; absorption = quantité incorporée dans le volume / dissoute.
Mécanismes : comment ça marche, concrètement ?
Adsorption : l’importance de la surface (même “invisible”)
Pour qu’il y ait adsorption efficace, il faut beaucoup de surface disponible. C’est la raison pour laquelle certains matériaux sont microporeux : leurs pores internes multiplient la surface de contact, parfois de façon gigantesque à l’échelle microscopique.
Deux grandes familles d’interactions
- Physisorption (interactions faibles) : forces de Van der Waals, interactions hydrophobes, etc. Souvent plus facilement réversible.
- Chimisorption (liaisons plus fortes) : interactions chimiques spécifiques entre la surface et la molécule. Souvent moins réversible.
Pourquoi certaines molécules s’adsorbent mieux que d’autres ?
- Taille et forme : une molécule trop grosse peut ne pas accéder à certains micropores.
- Polarité et charge : selon la surface (fonctionnalités chimiques) et le milieu (pH), l’affinité change.
- Solubilité : une molécule très “à l’aise” dans l’eau peut préférer rester dissoute plutôt que se fixer.
- Concurrence : plusieurs substances peuvent se disputer les mêmes sites d’adsorption.
Absorption : diffusion et “capacité interne”
Dans l’absorption, la substance traverse la surface puis se déplace à l’intérieur du matériau ou du liquide. C’est souvent une histoire de diffusion : plus c’est “facile de circuler” dans la matière, plus l’absorption progresse.
Ce qui influence l’absorption
- Température : elle peut accélérer la diffusion (selon le système).
- Temps de contact : plus le contact dure, plus la substance a le temps de pénétrer.
- Structure du matériau : porosité, tortuosité, gonflement possible, etc.
Exemples du quotidien (pour ne plus confondre)
Adsorption : “ça colle” sur une surface
- Charbon actif : capture de composés responsables d’odeurs et de goûts.
- Masques / filtres : certaines couches fixent des molécules sur leurs surfaces.
- Décoloration : certains adsorbants peuvent fixer des colorants.
Absorption : “ça entre” dans la matière
- Éponge : l’eau se retrouve dans l’épaisseur.
- Textiles : un tissu peut absorber un liquide (capillarité + pénétration).
- Gaz dissous : un gaz peut être absorbé par un liquide (dissolution).
Application en filtration de l’eau : où interviennent adsorption et absorption ?
Dans une cartouche de filtration, plusieurs mécanismes peuvent coexister. Comprendre adsorption et absorption aide à comprendre pourquoi certains composés sont bien réduits et d’autres beaucoup moins.
1) La filtration “mécanique” (tamisage) : surtout une histoire de taille
Lorsque l’on parle de microfiltration (par exemple une valeur indicative en microns), on parle essentiellement de la capacité à arrêter des particules plus grosses que les pores ou les canaux de passage. C’est très utile pour les sédiments, la turbidité, certaines particules en suspension, etc.
- Plus le passage est fin, plus on retient des particules… mais plus la perte de charge peut augmenter (débit plus faible).
- Ce mécanisme n’est pas l’adsorption : il s’agit d’un “arrêt” par taille, comme un tamis.
2) Le charbon actif : un champion de l’adsorption
Le charbon actif est connu pour sa très grande surface interne. De nombreuses molécules organiques (notamment responsables de goûts/odeurs, certains résidus de pesticides ou de médicaments) peuvent s’y adsorber selon leur affinité avec cette surface et selon les conditions d’usage.
Ce qui aide généralement l’adsorption sur charbon
- Temps de contact suffisant : plus l’eau passe lentement, plus les molécules ont le temps de se fixer.
- Eau moins chargée en compétition : si beaucoup de composés se disputent les sites, l’efficacité sur un composé précis peut diminuer.
- Surface adaptée : le type de charbon (matière première, activation, taille des pores) influence les familles de molécules captées.
Ce qui est plus difficile à adsorber
- Certains ions très solubles : des espèces ioniques (comme certains nitrates) peuvent être moins bien retenues par adsorption sur charbon, selon la chimie du système.
- Molécules très petites et très hydrophiles : elles peuvent préférer rester dissoutes.
3) Absorption : présente, mais souvent moins “mise en avant”
Dans certains médias filtrants, on peut aussi parler d’absorption au sens de pénétration dans la matrice (par exemple des polymères ou des supports capables d’incorporer des substances). En filtration domestique, le terme est parfois utilisé de manière générale, mais en pratique, la réduction de nombreuses molécules indésirables est surtout associée à l’adsorption (charbon actif) et à d’autres mécanismes (échange d’ions, catalyse, etc.) selon la technologie.
4) Et les minéraux “essentiels” ?
L’eau peut contenir des minéraux sous forme d’ions dissous (calcium, magnésium, etc.). Selon la technologie de traitement, ces ions peuvent être :
- peu modifiés (par exemple avec une filtration qui vise surtout les goûts/odeurs et certains organiques via adsorption),
- ou réduits (par exemple avec des résines échangeuses d’ions ou de l’osmose inverse, qui retirent beaucoup plus largement les espèces dissoutes).
Autrement dit, la “sélectivité” ne se résume pas à “bon vs mauvais” : elle dépend du mécanisme dominant et des propriétés physico-chimiques des substances (charge, taille, polarité, solubilité) ainsi que du média filtrant.
Limites, idées reçues et points de vigilance
“Adsorption = électroaimant” : une image utile, mais à nuancer
Comparer l’adsorption à un “aimant” aide à visualiser l’idée d’affinité, mais l’adsorption n’est pas toujours un simple jeu de charges opposées. Il peut s’agir :
- d’interactions hydrophobes (une molécule “fuit” l’eau et préfère la surface),
- de forces de Van der Waals,
- ou d’interactions chimiques plus spécifiques.
“0,5 µ” : la taille ne dit pas tout pour les molécules dissoutes
Les seuils en microns sont très parlants pour les particules. En revanche, beaucoup de molécules dissoutes (pesticides, résidus pharmaceutiques) sont à des échelles bien plus petites qu’un micron. Leur réduction dépend donc souvent davantage :
- de l’adsorption (si le média est adsorbant),
- du temps de contact,
- de la saturation progressive du média,
- et des conditions de l’eau (pH, température, composés concurrents).
Saturation : pourquoi une cartouche n’est pas “éternelle”
Un adsorbant possède une capacité finie. Au fil du temps, les sites d’adsorption se remplissent : c’est la saturation. C’est une des raisons majeures pour lesquelles les cartouches ont des durées d’usage recommandées.
Mesurer “ce qui est retenu” : l’importance des analyses
Deux eaux différentes ne se comportent pas de la même façon. Une filtration qui fonctionne très bien sur une eau peut être moins performante sur une autre (composition, charge organique, débit, etc.). Pour objectiver, les analyses et protocoles d’essai sont les meilleurs outils.
FAQ : adsorption et absorption
Pourquoi confond-on si souvent adsorption et absorption ?
Les deux mots se ressemblent et décrivent tous deux une “capture” d’une substance. La différence tient surtout au lieu : surface (adsorption) vs volume (absorption).
Une même cartouche peut-elle faire les deux ?
Oui. Un système de filtration peut combiner plusieurs mécanismes : tamisage mécanique, adsorption sur une surface poreuse, diffusion/absorption dans une matrice, et parfois d’autres phénomènes (échange d’ions, réactions catalytiques).
Est-ce que l’adsorption marche mieux si l’eau passe plus lentement ?
Souvent, oui : un temps de contact plus long favorise la fixation, surtout lorsque la molécule a besoin de temps pour accéder aux pores internes et trouver des sites d’adsorption.
Les nitrates sont-ils forcément “mal retenus” ?
La réduction des nitrates dépend fortement de la technologie. Le charbon actif n’est généralement pas le média le plus adapté à cette cible. D’autres approches existent (résines échangeuses d’ions, procédés membranaires, etc.), chacune avec ses avantages et contraintes.
Conclusion : retenir l’essentiel des notions adsorption et absorption
- Absorption : la substance pénètre dans la masse d’un matériau ou se dissout dans un liquide.
- Adsorption : la substance se fixe sur une surface (souvent dans des pores), grâce à des interactions physiques/chimiques.
- En filtration de l’eau, la réduction de nombreuses molécules organiques est souvent liée à l’adsorption (notamment sur charbon actif), tandis que la filtration “en microns” décrit surtout une rétention par taille de particules.
Si vous souhaitez approfondir la notion d’adsorption d’un point de vue chimie des surfaces, l’article Wikipédia constitue une première lecture accessible : https://fr.wikipedia.org/wiki/Adsorption.