Mecanismos de adsorción y absorción
- Definiciones sencillas
- Las diferencias esenciales
- Mecanismos: superficie, poros, afinidad
- Ejemplos cotidianos
- Aplicación en filtración de agua
- Límites, ideas preconcebidas y puntos a tener en cuenta
- PREGUNTAS FRECUENTES
A menudo me preguntan: ¿cómo es posible que el filtro Amilo retenga las moléculas de pesticidas o medicamentos y no las de minerales esenciales para la salud? ¿Cómo es posible esta clasificación de moléculas "buenas" y "malas"?
¡Gracias a la adsorción y la absorción!
Absorción : gracias a miles de «tubos trampa», el cartucho retiene las partículas más grandes mediante un modo de retención. Se trata de un modo «mecánico».
Adsorción : El cartucho actúa como un electroimán que «pega» las moléculas indeseables por polaridad. Por eso, las moléculas orgánicas (minerales...) quedan libres, mientras que las moléculas sintéticas (pesticidas, metales pesados) quedan atrapadas, ya que tienen una carga opuesta a la del carbón. Esta es la razón por la que el filtro Amilo retiene pocos nitratos, que son moléculas orgánicas. Dicho esto, la cuestión de los nitratos divide a la comunidad científica y le invito a leer los documentos PDF que encontrará aquí. Estamos hablando de microfiltración y la cifra de 0,5 µ dada por Amilo es relativa, ya que, debido al fenómeno de adsorción descrito anteriormente, las partículas aún más pequeñas pueden ser «imantadas».
Para los aficionados a la química, aquí está el artículo de Wiki: https://fr.wikipedia.org/wiki/Adsorption
Nota importante: En lo que sigue, las explicaciones son deliberadamente pedagógicas. En la práctica, la retención de un contaminante depende a menudo de varios fenómenos combinados (tamaño, forma, solubilidad, interacciones químicas, velocidad de flujo, etc.).
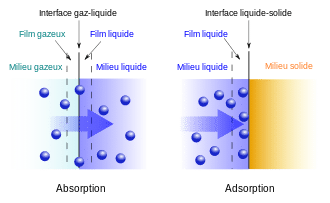
Definiciones sencillas: adsorción y absorción
¿Qué es la absorción?
La absorción corresponde a la penetración de una sustancia en el volumen de un material (o un líquido). En otras palabras, la sustancia no solo permanece en la superficie: “entra” y se distribuye en el interior.
- Ejemplo: una esponja que “absorbe” agua (el agua queda retenida en el interior de la esponja).
- Ejemplo: dióxido de carbono que se disuelve en el agua (absorción/disolución en el líquido).
¿Qué es la adsorción?
La adsorción corresponde a la fijación de una sustancia en la superficie de un material. La sustancia se adhiere a las paredes externas o internas (en los poros), sin “entrar” necesariamente en el material en términos de volumen.
- Ejemplo: moléculas que se fijan al carbón activado.
- Ejemplo: olores captados por ciertos materiales porosos.
A recordar: absorción = “en la masa”, adsorción = “en la superficie”.
Las diferencias esenciales (en un minuto)
- Lugar del fenómeno : adsorción en una superficie; absorción en un volumen.
- Materiales típicos : adsorción con superficies muy desarrolladas (carbón activo, zeolitas, resinas); absorción con materiales capaces de ’ingerir“ (esponjas, disolventes, polímeros, ciertos geles).
- Velocidad : la adsorción puede ser muy rápida al principio (superficie disponible) y luego ralentizarse; la absorción depende a menudo de la difusión interna.
- Reversibilidad : ambos pueden ser reversibles, pero depende de las interacciones y las condiciones (temperatura, concentración, pH, etc.).
- Lo que se mide : adsorción = cantidad fijada por unidad de superficie/masa; absorción = cantidad incorporada en el volumen/disuelta.
Mecanismos: ¿cómo funcionan en la práctica?
Adsorción: la importancia de la superficie (incluso “invisible”)
Para que la adsorción sea eficaz, se necesita una gran superficie disponible. Por eso algunos materiales son microporoso : sus poros internos multiplican la superficie de contacto, a veces de forma gigantesca a escala microscópica.
Dos grandes familias de interacciones
- Fisisorción (interacciones débiles): fuerzas de Van der Waals, interacciones hidrofóbicas, etc. A menudo más fácilmente reversible.
- Quimisorción (enlaces más fuertes): interacciones químicas específicas entre la superficie y la molécula. A menudo menos reversible.
¿Por qué algunas moléculas se adsorben mejor que otras?
- Tamaño y forma : una molécula demasiado grande puede no acceder a ciertos microporos.
- Polaridad y carga : según la superficie (propiedades químicas) y el medio (pH), la afinidad cambia.
- Solubilidad : una molécula que se encuentra muy “cómoda” en el agua puede preferir permanecer disuelta en lugar de fijarse.
- Competencia : varias sustancias pueden competir por los mismos sitios de adsorción.
Absorción: difusión y “capacidad interna”
En la absorción, la sustancia atraviesa la superficie y luego se desplaza. en el interior del material o del líquido. A menudo es una cuestión de difusión: cuanto más “fácil es circular” por el material, más avanza la absorción.
Lo que influye en la absorción
- Temperatura : puede acelerar la difusión (dependiendo del sistema).
- Tiempo de contacto : cuanto más dura el contacto, más tiempo tiene la sustancia para penetrar.
- Estructura del material : porosidad, tortuosidad, posible hinchazón, etc.
Ejemplos cotidianos (para no confundirlos más)
Adsorción: “se adhiere” a una superficie.
- Carbón activado : captura de compuestos responsables de olores y sabores.
- Máscaras / filtros : algunas capas fijan moléculas en sus superficies.
- Decoloración : algunos adsorbentes pueden fijar colorantes.
Absorción: “entra” en la materia.
- Esponja : el agua se encuentra en el espesor.
- Textiles : un tejido puede absorber un líquido (capilaridad + penetración).
- Gas disuelto : un gas puede ser absorbido por un líquido (disolución).
Aplicación en la filtración del agua: ¿dónde intervienen la adsorción y la absorción?
En un cartucho filtrante pueden coexistir varios mecanismos. Comprender adsorción y absorción ayuda a comprender por qué algunos compuestos se reducen bien y otros mucho menos.
1) La filtración “mecánica” (tamizado): sobre todo una cuestión de tamaño
Cuando se habla de microfiltración (por ejemplo, un valor indicativo en micras), se hace referencia esencialmente a la capacidad de detener partículas. más grandes que los poros o los canales de paso. Es muy útil para los sedimentos, la turbidez, ciertas partículas en suspensión, etc.
- Cuanto más fino es el paso, más partículas se retienen... pero mayor puede ser la pérdida de carga (menor caudal).
- Este mecanismo no es adsorción: se trata de una “retención” por tamaño, como un tamiz.
2) El carbón activo: un campeón de la adsorción
El carbón activado es conocido por su gran superficie interna. Muchas moléculas orgánicas (responsables, entre otras cosas, de sabores y olores, así como de ciertos residuos de pesticidas o medicamentos) pueden adherirse a él. adsorber según su afinidad con esta superficie y según las condiciones de uso.
Lo que suele ayudar a la adsorción sobre carbón
- Tiempo de contacto suficiente : cuanto más lentamente pasa el agua, más tiempo tienen las moléculas para fijarse.
- Agua menos cargada en competición : si muchos compuestos compiten por los sitios, la eficacia sobre un compuesto específico puede disminuir.
- Superficie adecuada : el tipo de carbón (materia prima, activación, tamaño de los poros) influye en las familias de moléculas capturadas.
Lo que es más difícil de adsorber
- Algunos iones muy solubles : algunas especies iónicas (como ciertos nitratos) pueden retenerse menos bien por adsorción sobre carbón, dependiendo de la química del sistema.
- Moléculas muy pequeñas y muy hidrófilas. : pueden preferir permanecer disueltas.
3) Absorción: presente, pero a menudo menos “destacada”.”
En algunos medios filtrantes, también se puede hablar de absorción en el sentido de penetración en la matriz (por ejemplo, polímeros o soportes capaces de incorporar sustancias). En la filtración doméstica, el término se utiliza a veces de manera general, pero en la práctica, La reducción de numerosas moléculas indeseables se asocia principalmente a la adsorción (carbón activo) y a otros mecanismos (intercambio iónico, catálisis, etc.) según la tecnología.
4) ¿Y los minerales “esenciales”?
El agua puede contener minerales en forma de ionenes disueltos (calcio, magnesio, etc.). Según la tecnología de tratamiento, estos iones pueden ser:
- poco modificados (por ejemplo, con una filtración que se centra principalmente en los sabores/olores y ciertos compuestos orgánicos mediante adsorción),
- o reducidos (por ejemplo, con resinas intercambiadoras de iones u ósmosis inversa, que eliminan en mayor medida las especies disueltas).
En otras palabras, la “selectividad” no se reduce a “bueno frente a malo”: depende del mecanismo dominante y de las propiedades fisicoquímicas de las sustancias (carga, tamaño, polaridad, solubilidad), así como del medio filtrante.
Límites, ideas preconcebidas y puntos a tener en cuenta
“Adsorción = electroimán”: una imagen útil, pero que hay que matizar.
Comparar la adsorción con un “imán” ayuda a visualizar la idea de afinidad, pero la adsorción no siempre es un simple juego de cargas opuestas. Puede tratarse de:
- interacciones hidrofóbicas (una molécula “huye” del agua y prefiere la superficie),
- de fuerzas de Van der Waals,
- o interacciones químicas más específicas.
“0,5 µ”: el tamaño no lo dice todo en el caso de las moléculas disueltas
Los umbrales en micras son muy reveladores para las partículas. Sin embargo, muchas moléculas disueltas (pesticidas, residuos farmacéuticos) tienen un tamaño mucho menor que una micra. Por lo tanto, su reducción depende a menudo más de:
- de la adsorción (si el medio es adsorbente),
- tiempo de contacto,
- de la saturación progresiva de los medios de comunicación,
- y las condiciones del agua (pH, temperatura, compuestos competidores).
Saturación: por qué un cartucho no es “eterno”
Un adsorbente tiene una capacidad finita. Con el tiempo, los sitios de adsorción se llenan: es la saturación. Esta es una de las principales razones por las que los cartuchos tienen una vida útil recomendada.
Medir “lo que se retiene”: la importancia de los análisis
Dos aguas diferentes no se comportan de la misma manera. Una filtración que funciona muy bien con un tipo de agua puede ser menos eficaz con otro (composición, carga orgánica, caudal, etc.). Para objetivar, los análisis y los protocolos de ensayo son las mejores herramientas.
Preguntas frecuentes: adsorción y absorción
¿Por qué se confunden tan a menudo la adsorción y la absorción?
Ambas palabras son similares y describen la “captura” de una sustancia. La diferencia radica principalmente en el lugar: superficie (adsorción) frente a volumen (absorción).
¿Puede un mismo cartucho hacer ambas cosas?
Sí. Un sistema de filtración puede combinar varios mecanismos: tamizado mecánico, adsorción en una superficie porosa, difusión/absorción en una matriz y, en ocasiones, otros fenómenos (intercambio iónico, reacciones catalíticas).
¿Funciona mejor la adsorción si el agua pasa más lentamente?
A menudo, sí: un tiempo de contacto más prolongado favorece la fijación, sobre todo cuando la molécula necesita tiempo para acceder a los poros internos y encontrar sitios de adsorción.
¿Los nitratos son necesariamente “mal retenidos”?
La reducción de nitratos depende en gran medida de la tecnología. El carbón activo no suele ser el medio más adecuado para este objetivo. Existen otros métodos (resinas de intercambio iónico, procesos de membrana, etc.), cada uno con sus ventajas y limitaciones.
Conclusión: recordar los conceptos básicos de adsorción y absorción.
- Absorción : la sustancia penetra en la masa de un material o se disuelve en un líquido.
- Adsorción : la sustancia se fija sobre una superficie (a menudo en los poros), gracias a interacciones físicas/químicas.
- En la filtración del agua, la reducción de numerosas moléculas orgánicas suele estar relacionada con la adsorción (especialmente sobre carbón activo), mientras que la filtración “en micras” describe principalmente una retención por tamaño de partículas.
Si desea profundizar en el concepto de adsorción desde el punto de vista de la química de superficies, el artículo de Wikipedia es una primera lectura accesible: https://fr.wikipedia.org/wiki/Adsorption.